Científicos del Centro de Ingeniería del Genoma del Instituto de Ciencias Básicas (IBS) en Daejeon, Corea del Sur, han desarrollado una herramienta programable capaz de realizar conversiones de base de adenina (A) a guanina (G) en el genoma mitocondrial humano.
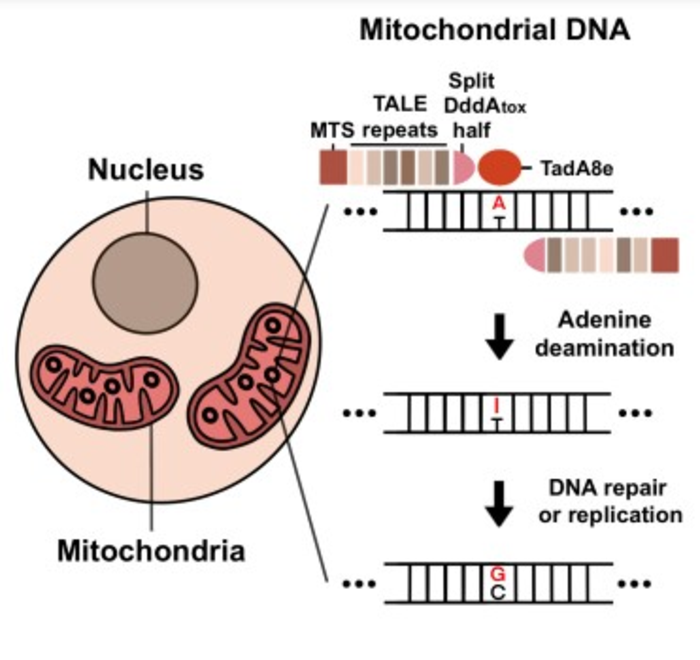
Los editores principales utilizados en la nueva plataforma de edición de genes mitocondriales se denominan TALED (desaminasas vinculadas a efectores similares a activadores de transcripción) y constan de tres componentes: un TALE personalizado (efector similar a activadores de transcripción) que apunta a una secuencia de ‘ADN, un desoxiadenosina desaminasa (TadA8e) derivada de la Escherichia coli la proteína TadA que convierte A en G, y una citidina desaminasa (DddA) catalíticamente alterada, de longitud completa o dividida, que desenrolla el ADN y lo hace más accesible a TadA8e.
Sung-Ik Cho, PhD, primer autor del nuevo estudio, dijo: “Hemos creado una nueva plataforma de edición de genes, TALED, que puede lograr la conversión de A a G. Nuestro nuevo editor de base ha ampliado enormemente el alcance de la edición del genoma mitocondrial. Esto puede hacer una gran contribución, no solo a la creación de un modelo de enfermedad, sino también al desarrollo de un tratamiento.
Los detalles de la nueva plataforma de edición de mtDNA se han publicado en la revista. Célulaen un artículo titulado, “Edición de base A a G dirigida en ADN mitocondrial humano con desaminasas programables.”
“Este es un estudio oportuno e interesante que amplía la caja de herramientas de edición del genoma con desaminasas asociadas a TALE para mutaciones de precisión de la A a la G. La prueba de concepto en el ADN mitocondrial humano es alentadora, con cifras de eficacia que permiten la génesis de modelos de enfermedades. Si bien es necesario para mejorar la especificidad de las aplicaciones traslacionales y clínicas, es una extensión práctica del conjunto de herramientas de edición del genoma para un conjunto de aplicaciones en el ADN mitocondrial con fondos insuficientes, con potencial para las células de mamíferos y más”, dijo Rodolphe Barrangou, PhD. , profesor emérito de ciencias de la alimentación, bioprocesos y nutrición en la Universidad Estatal de Carolina del Norte y editor de El registro CRISPR.
La capacidad de modificar el código genómico aumentó gradualmente con los descubrimientos de las enzimas de restricción en 1968, la reacción en cadena de la polimerasa en 1985, las nucleasas con dedos de zinc en 1996, las interacciones efectoras TAL-DNA en 2009, la edición del gen CRISPR-Cas9 en 2012 y la edición central. . en 2016. Estos descubrimientos han hecho posible tratar enfermedades genéticas previamente incurables mediante la edición de mutaciones causantes de enfermedades en el genoma humano. Sin embargo, las herramientas de edición del genoma de células vivas se han centrado en gran medida en el genoma nuclear.
Las mutaciones en el ADN mitocondrial circular heredado de la madre (ADNmt) son responsables de varias enfermedades graves. Hay 90 mutaciones puntuales patogénicas conocidas en el mtDNA que afectan al menos a 1 de cada 5000 personas.
«Hay enfermedades hereditarias extremadamente desagradables debido a defectos en el ADNmt. Por ejemplo, la neuropatía óptica hereditaria de Leber (LHON, por sus siglas en inglés), que causa ceguera repentina en ambos ojos, es causada por una mutación de un solo punto en el ADNmt, dijo Jin-Soo Kim, PhD, director del Centro de Ingeniería Genómica del IBS y autor principal.
Además, MELAS (encefalomiopatía mitocondrial con acidosis láctica y episodios similares a accidentes cerebrovasculares) ataca gradualmente el cerebro del paciente. Otros estudios sugieren que las anomalías del mtDNA pueden ser responsables de enfermedades degenerativas como la enfermedad de Alzheimer y la distrofia muscular.
Las herramientas de edición del genoma existentes no se pueden utilizar para editar el mtDNA, principalmente debido a las limitaciones en los métodos de entrega. Por ejemplo, los ARN guía utilizados en la plataforma CRISPR-Cas no pueden penetrar en las mitocondrias.
“Otro problema es que hay escasez de modelos animales de estas enfermedades mitocondriales. De hecho, actualmente no es posible diseñar las mutaciones mitocondriales necesarias para crear modelos animales”, dijo Kim. «La falta de modelos animales hace que sea muy difícil desarrollar y probar terapias para estas enfermedades».
Con el descubrimiento de los editores de base de citosina derivados de DddA (DdCBE) en 2020 por un equipo dirigido por David Liu, PhD, profesor del Instituto Broad de Harvard y MIT, y Joseph Mougous, PhD, profesor de la Universidad de Washington, fue Es posible realizar conversiones de citosina (C) a timina (T) en mtDNA sin crear roturas de ADN de doble cadena. Sin embargo, los DdCBE se limitaron en gran medida a las conversiones de C a T en el motivo TC y solo pudieron corregir alrededor del 10 % de las mutaciones puntuales mitocondriales patógenas.
Liu, que no participó en el estudio actual, dijo GEN“Jin-Soo y su grupo muestran maravillosamente cómo la integración de nuestro editor de base de citosina mitocondrial y la enzima desaminasa que desarrollamos para nuestros editores de base de adenina nuclear puede lograr un objetivo importante en el campo: la edición de base de adenina en el ADN mitocondrial Aunque el ADN mitocondrial Las mutaciones causan muchas enfermedades genéticas graves, las mitocondrias hasta ahora se han resistido a la edición genética de precisión debido a la dificultad de introducir los ARN guía CRISPR en las mitocondrias.
Liu agregó: “En 2020, informamos sobre los primeros editores de base sin CRISPR (DdCBE) que superan esta limitación mediante el uso de proteínas, en lugar de complejos de proteína-ARN CRISPR, para apuntar programáticamente al ADN en las mitocondrias. Usando esta arquitectura DdCBE, junto con una desaminasa de desoxiadenosina que desarrollamos en nuestro laboratorio para respaldar la edición de base de adenina de alta eficiencia, el laboratorio de Jin-Soo desarrolló con éxito los primeros editores de base de adenina mitocondrial. Debido a que la edición de la base de adenina puede, en principio, corregir muchas mutaciones del ADN mitocondrial que causan enfermedades genéticas, el trabajo de su grupo es un avance clave hacia la corrección precisa de las mutaciones mitocondriales que causan enfermedades.
Sorprendentemente, TadA8e puede cambiar A a G en el genoma mitocondrial humano de doble cadena cuando el E. coli El genoma consiste en ADN monocatenario.
Kim dijo: “Nadie pensó antes en usar TadA8e para realizar la edición de bases en las mitocondrias porque se supone que es específico del ADN monocatenario. Es este enfoque original lo que realmente nos ayudó a inventar TALED. »
El equipo planteó la hipótesis de que dividir DddA permite a TadA8a acceder al ADN de doble cadena desenrollándolo transitoriamente, lo que permite a TadA8e realizar rápidamente los cambios necesarios. Además de ajustar los componentes de TALED, los investigadores también desarrollaron una tecnología capaz de editar simultáneamente la base A-to-G y C-to-T, así como la edición solo base A-to-G.
Los autores informaron que los TALED diseñados a medida convirtieron eficientemente A en G en células humanas en 17 sitios objetivo en diferentes genes mitocondriales, con frecuencias de edición de hasta el 49 %.
El equipo aplicó los nuevos TALED mediante la creación de un solo clon derivado de células que contenía los cambios de ADNmt deseados. Además, los TALED no mostraron citotoxicidad y mantuvieron la integridad del ADNmt. Los TALED no generaron cambios indeseables fuera del objetivo en el ADN nuclear y muy pocos efectos fuera del objetivo en el ADNmt.
En estudios futuros, los investigadores tienen la intención de mejorar los TALED aumentando la eficiencia y especificidad de la edición, para allanar el camino para la aplicación de la tecnología en pacientes. El equipo también está desarrollando TALED adecuados para la edición de bases A a G en el ADN del cloroplasto.
También te puede interesar
-
Las imágenes de alta velocidad y la IA nos ayudan a comprender cómo funcionan las alas de los insectos
-
Tarta de chocolate y sueños marcianos: el helicóptero Ingenuity se despide agridulce | Noticias científicas
-
Brillantes auroras iluminan a los fotógrafos del sur
-
Nuevo descubrimiento: algas y bacterias se fusionan para formar un solo organismo en un laboratorio | Noticias científicas
-
Los astrónomos descubren 454 nuevos asteroides en el cinturón principal